De waterstofbrug
 Onder moleculen bevinden zich enkele krachten die zich manifesteren in alledaagse verschijnselen. Een van deze krachten zorgt ervoor dat ethanol (drinkbare alcohol) oplosbaar is, water een vloeistof is op kamertemperatuur en wij vitamine C kunnen uitscheiden via urine indien er een overschot aanwezig is in ons lichaam. Deze kracht is fundamenteel in de scheikunde, omdat er veel verschijnselen mee verklaard kunnen worden. En die kracht is het slaan van een waterstofbrug.
Onder moleculen bevinden zich enkele krachten die zich manifesteren in alledaagse verschijnselen. Een van deze krachten zorgt ervoor dat ethanol (drinkbare alcohol) oplosbaar is, water een vloeistof is op kamertemperatuur en wij vitamine C kunnen uitscheiden via urine indien er een overschot aanwezig is in ons lichaam. Deze kracht is fundamenteel in de scheikunde, omdat er veel verschijnselen mee verklaard kunnen worden. En die kracht is het slaan van een waterstofbrug.
Wat is een waterstofbrug?
In de organische scheikunde hebben we te maken met krachten. Een van deze krachten is de waterstofbrug. De waterstofbrug is een zeer krachtige polaire "binding" tussen twee moleculen die waterstofbruggen kunnen slaan tussen elkaar. Omdat deze binding zeer krachtig is, blijft water bijvoorbeeld een vloeistof tot 100 °C. De waterstofbrug is dus een zeer sterke kracht die moleculen bij elkaar houdt. Ook is de waterstofbrug verantwoordelijk voor de oplosbaarheid van stoffen; indien iemand ethanol of suiker probeert op te lossen in water, zal hij zien dat dit heel gemakkelijk gaat. Dit kan verklaard worden door de chemische bouw van dergelijke producten.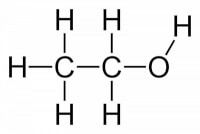 Figuur 1: Ethanol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
Figuur 1: Ethanol / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)Wat maakt stoffen oplosbaar?
Ethanol en suiker zijn enkele voorbeelden van talrijke stoffen die goed oplosbaar zijn in water. Dit kan worden verklaard aan de hand van de structuurformule van deze stoffen. In figuur 1 is de structuurformule van ethanol te zien. Ethanol zit onder meer in bier en wijn, als product van fermentatie. Ethanol ontsnapt niet van het water in het drankje, omdat de aanwezigheid van een OH-groep (officieel: alcoholgroep) waterstofbruggen slaat tussen het ethanol-molecuul en water. Vanwege de sterke aantrekkingskracht tussen de watermoleculen en de OH-groep van het ethanol blijft het ethanol opgelost, waardoor het niet kan ontsnappen aan de oplossing.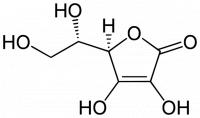 Figuur 2: L-Ascorbinezuur, vitamine C / Bron: Yikrazuul, Wikimedia Commons (Publiek domein)
Figuur 2: L-Ascorbinezuur, vitamine C / Bron: Yikrazuul, Wikimedia Commons (Publiek domein)In het voorbeeld met ethanol werd duidelijk dat één OH-groep volstaat. Dit is niet per definitie zo. In het geval van grotere moleculen met lange apolaire koolstofketens (water is polair, dus apolaire ketens lossen slecht op in water) is het handig als het stofje meer OH-groepen heeft om op te lossen. In de praktijk geldt namelijk dat hoe meer OH-groepen een stof bezit, hoe beter oplosbaar dit stofje zal zijn in water. In figuur 2 is vitamine C afgebeeld. Vitamine C beschikt over vier OH-groepen, die zijn verspreid over het molecuul. Hierdoor is het zeer makkelijk om vitamine C op te lossen in water. Vooral voor het lichaam is deze kwaliteit handig. Bij een overdosis vitaminen heeft het lichaam moeite met het verwerken van de stoffen, waardoor complicaties kunnen optreden. In het geval van vitamine C lost het lichaam het overschot op in de urine, waardoor het overschot vitamine C zo het lichaam kan verlaten, zonder complicaties.
Wat is de theorie achter de waterstofbrug?
Het slaan van een waterstofbrug heeft te maken met de elektronegativiteit van een gegeven groep. De elektronegativiteit van een atoom geeft aan hoe sterk een atoom een elektronenpaar naar zich toe trekt. Hoe harder een atoom deze elektronenparen naar zich toe trekt, hoe elektronegatiever het atoom, en daarom hoe meer gepolariseerd het molecuul, indien het atoom een binding aangaat. Er zijn maar drie (met uitzondering van een zwakkere binding) atomen die, in een binding met waterstof, een waterstofbrug kunnen slaan met andere atomen.| Atoom | Naam atoom | Elektronegativiteit |
|---|---|---|
| H | Waterstof | 2,1 |
| F | Fluor | 4,0 |
| O | Zuurstof | 3,5 |
| N | Stikstof | 3,0 |
De elektronegativiteit van deze stoffen ligt erg hoog. Niet alleen een OH-groep hoeft aanwezig te zijn voor het slaan van waterstofbruggen: een NH-groep of waterstoffluoride (HF) lossen ook gemakkelijk op. In het geval van ethanol is de elektronegativiteit van de OH-groep 3,5 - 2,1 = 1,4. Hier wordt duidelijk dat zuurstof veel harder trekt aan het elektronenpaar in de binding, waardoor zuurstof, in vergelijking met waterstof, negatief geladen wordt. De ladingen die worden gemaakt bij dit soort bindingen worden partiële ladingen genoemd. Hierdoor kan een ander molecuul met een OH-groep een waterstofbrug slaan tussen de lichtelijk positief geladen waterstof van het eigen molecuul, en het lichtelijk negatief geladen zuurstof van het andere molecuul. Omdat deze aantrekkingskracht heel sterk is lost een stof gemakkelijk op indien er een OH- of NH-groep aanwezig is.
Uitzondering op de regel
Waterstofbruggen kunnen geslagen worden tussen componenten van zuurstof, stikstof en fluoride, allen in combinatie met waterstof. Hierdoor wordt de oplosbaarheid van stoffen bepaald. Toch is er een uitzondering.| Binding | Elektronegativiteit |
|---|---|
| C = O | 1,3 |
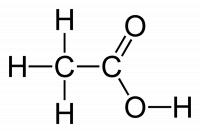 Figuur 3: azijnzuur, officieel ethaanzuur / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)
Figuur 3: azijnzuur, officieel ethaanzuur / Bron: Benjah bmm27, Wikimedia Commons (Publiek domein)Kookpunt
Zonder waterstofbruggen zou het niet mogelijk zijn voor water om een vloeistof te blijven op kamertemperatuur; het zou in een gas veranderen. Tussen watermoleculen vindt constante interactie plaats wat betreft waterstofbruggen. Water bestaat immers uit een zuurstofmolecuul en twee waterstofmoleculen. Dit maakt water zeer polair, waardoor het sterke waterstofbruggen kan slaan tussen andere watermoleculen, die, op hun beurt, ook waterstofbruggen slaan met andere watermoleculen, enzovoort. Hierdoor stijgt het kookpunt van water, wat is vastgelegd op 373 Kelvin (100 °C). Maar ook andere stoffen die waterstofbruggen kunnen aanleggen zien een stijging in kookpunt. In het tabel hieronder zijn enkele stoffen, met hun kookpunt, weergegeven.| Naam | Kookpunt (°C) |
|---|---|
| Water | 100 |
| Ethaanzuur | 118,5 |
| Butaanzuur | 163,75 |
| Ethanol | 79 |
| Propaan-1,3-diol | 213 |
Gerelateerde artikelen
Bronnen en referenties
- Inleidingsfoto: Derplani, Pixabay
- https://en.wikipedia.org/wiki/Butyric_acid
- BiNaS, ISBN 9789001817497
- Afbeelding bron 1: Benjah bmm27, Wikimedia Commons (Publiek domein)
- Afbeelding bron 2: Yikrazuul, Wikimedia Commons (Publiek domein)
- Afbeelding bron 3: Benjah bmm27, Wikimedia Commons (Publiek domein)
Reacties
Noam, 09-03-2018
Chloor heeft een elektronegativiteit van 3,16, aangezien dit meer dan 0,5 verschilt van de 2,2 van waterstof zouden er bij HCl toch ook waterstofbruggen moeten kunnen vormen?
Reactie infoteur, 12-03-2018
HCl gaat geen waterstofbrug aan omdat het chloor-ion te groot is en zodoende een te lage elektronendichtheid heeft. Ook dissocieert het molecuul in water omdat HCl een sterk zuur is. Dus ondanks het feit dat Cl een hoge elektronegativiteit heeft, gaat deze geen waterstofbrug-binding aan. De enige bindingen waarbij een waterstofbrug voorkomt zijn N-H, F-H en O-H bindingen (carbonylverbindingen ook, maar deze laat ik even achterwege). Deze zijn allemaal voldoende elektronegatief en t.o.v. chloor kleine atomen, waardoor hun elektronendichtheid toeneemt en zij dus een waterstofbrug kunnen vormen met andere soortgelijke moleculen.
Marit, 15-12-2016
Kan een zuurstofatoom twee of een waterstofbrug vormen? En waarom is het kookpunt van water hoger dan waterfluoride, terwijl fluor een grotere elektronegativiteit heeft?
Reactie infoteur, 16-12-2016
Hoi Marit,
Een zuurstofatoom kan twee waterstofbruggen vormen in een binding. In water is het dus mogelijk voor een watermolecuul om vier waterstofbruggen te slaan.
Een oorzaak van het lagere kookpunt van HF is omdat het enkel bestaat uit waterstof en fluoride, oftewel, er kunnen per HF molecuul twee waterstofbruggen worden geslagen, terwijl dit in water er 4 zijn (twee door zuurstof, twee door de twee waterstof) waardoor de intermoleculaire krachten aanzienlijk sterker zijn onder watermoleculen dan onder waterstoffluoride.
Het klopt dat fluor een grotere elektronegativiteit heeft en dus harder trekt aan het elektronenpaar, waardoor het molecuul een hogere partiële lading heeft aan beide kanten. Toch blijft de regel hier gelden dat water twee keer zo veel waterstofbruggen slaat dan waterstoffluoride, wat het kookpunt aanzienlijk doet stijgen.
Ik hoop je vraag zo goed te hebben beantwoord!
Laatste update: 18-04-2017
Rubriek: Wetenschap
Subrubriek: Scheikunde
Bronnen en referenties: 6